马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有帐号?注册
x

复旦大学附属中山医院普通外科团队 杨亮亮 任黎 通信作者:任黎 [size=1em]本文来源 中华消化外科杂志2016年2月第15卷第2期185-189页
作者单位 复旦大学附属中山医院结直肠外科
摘 要
目的 探讨同时性结肠癌肝转移转化治疗后行一期切除原发灶及肝转移灶的安全性及临床疗效。 方法 采用回顾性描述研究方法。收集2013年4月复旦大学附属中山医院收治的1例乙状结肠癌伴肝脏多发转移患者的临床资料。术前影像学检查结果示乙状结肠癌,肠周多发淋巴结,肝转移灶5个,2个转移灶直径较大分别为4.5cm和3.6cm;结肠镜病理学检查提示腺癌。经多学科团队讨论后行mFOL**6化疗联合贝伐珠单克隆抗体治疗后肝转移灶明显缩小,遂行结肠癌原发灶联合肝转移灶一期切除术,具体手术方式为开腹肝部分切除+3D腹腔镜辅助乙状结肠癌根治术。患者术后予常规应用抗生素及营养支持,术后行mFOL**6辅助化疗。观察指标:转化治疗后行肿瘤标志物检测、腹盆腔CT及腹上区MRI等检查,观察肝内转移灶大小变化,肿瘤标志物变化情况。术中观察手术时间、术中出血量、淋巴结清扫数目、生命体征等。术后观察患者肝功能、下床活动时间、**排气时间、引流管拔出时间、住院时间及术后并发症、病理学检查结果、肿瘤复发及转移情况。患者出院后每月行肿瘤标志物检测及B超、胸部X线片检查至2014年1月,每半年行腹盆腔CT、腹上区MRI及肠镜等检查,并通过门诊或电话方式进行随访了解肿瘤复发转移情况,随访时间截至2015年9月。 结果 患者术前进行4个周期化疗,经转化治疗1个月余,肝内2个较大转移灶直径缩小至3.2cm和2.0cm,肿瘤标志物CEA下降为95.9μg/L,CA19-9 下降为252.4kU/L,达到手术要求。患者顺利完成结肠癌原发灶联合肝转移灶一期切除术,手术时间为280min,术中出血量为250mL,未输血,清扫淋巴结14枚,均未见转移,另见癌结节1枚,患者术中生命体征平稳。患者术后恢复顺利,术后第1天ALT和AST分别为1147U/L和2631U/L,术后第7天分别为101U/L和37U/L。术后第2天下床活动,第3天**排气,第7天拔除引流管,第9天出院。患者术后未见明显吻合口瘘、出血及感染等并发症。术后病理学诊断:乙状结肠溃疡型腺癌T3N1cM1期(合并肝转移性腺癌)。患者术后第40天行方案为mFOL**6和口服卡培他滨的辅助治疗。患者随访30个月,生命质量良好,无复发转移出现。 结论 初始不可切除的结肠癌肝转移,经转化治疗后行一期切除原发灶及肝转移灶,手术安全可行,治疗效果好。
关 键 词
结肠肿瘤,低位; 肝转移,同时性; 转化治疗; 肠肝一期切除; 腹腔镜检查
结直肠癌是常见的消化道恶性肿瘤之一,在我国其发病率和病死率呈逐年上升趋势[1-2]。肝脏是结直肠癌最常见的转移部位,结直肠癌肝转移严重影响患者预后,已有的研究结果显示:>50%的结直肠癌患者会出现肝转移,然而初始即可切除的肝转移患者仅占10%~20%[3-5]。对于初始不可切除的结直肠癌肝转移,经转化治疗后行手术切除,患者预后可获得显著改善,是有望获得治愈的唯一手段[6-7]。随着新型化疗药物的不断开发及分子靶向药物的出现,转化治疗成功并且获得手术切除的患者比例明显上升[8]。同时外科理念及技术的不断进步,使得同期结直肠联合肝脏切除术的安全性得到保障,从而使肠肝一期切除手术应用越来越普遍[9-10]。本研究回顾性分析2013年4月我科收治的1例乙状结肠癌合并肝脏多发转移患者的临床资料,探讨同时性结肠癌肝转移转化治疗后行原发灶及转移灶一期切除术的安全性及临床疗效。 1 资料与方法 1.1 一般资料 采用回顾性描述研究方法。患者女,58岁。2012年无明显诱因出现大便带血,量少,色鲜红,自觉无其他不适,未予重视。2013年4月患者便血症状加重,大便习惯改变,次数增加达1~3次/d;大便性状改变,大便变细,同时伴体质量减轻、贫血等。于2013年4月行结肠镜检查提示距肛缘20cm可见包块,累及肠腔1/2周,病理学检查提示腺癌。PET/CT检查提示乙状结肠肿瘤,肠周多发淋巴结,肝脏多发转移灶。为进一步诊断与治疗于2013年4月收入我院。完善检查:其中盆腔MRI检查显示乙状结肠病灶(图1),肝脏MRI检查显示肝内5个转移灶,2个转移灶直径较大,分别为4.5cm和3.6cm(图2,3)。
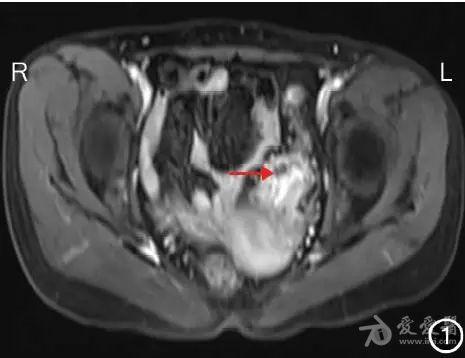
图1 转化治疗前MRI检查示乙状结肠病灶(→)
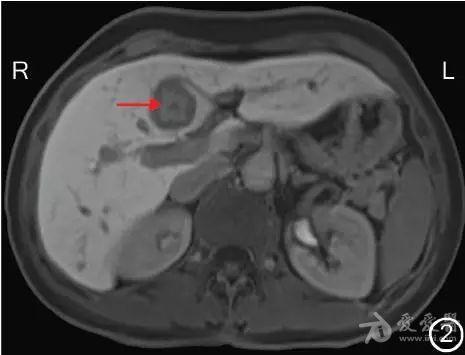
图2 转化治疗前MRI检查示肝左内叶转移灶(→)
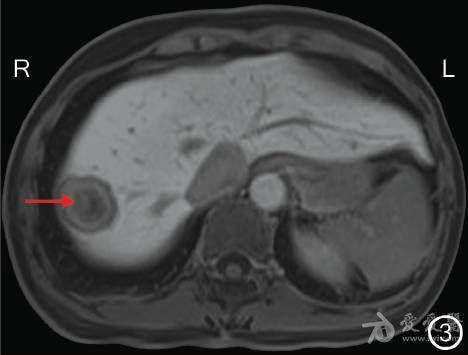
图3 转化治疗前MRI检查示肝右叶近膈顶转移灶(→)
肿瘤标志物CEA为605.2μg/L,CA19-9为1277.3kU/L。基因检测报告为KRAS突变型,NRAS、BRAF野生型。患者既往因子宫肌瘤行腹腔镜辅助全子宫及附件切除术。本研究通过我院伦理委员会批准,患者及家属术前均签署手术知情同意书。
1.2 术前转化治疗 患者在我院完善检查后经多学科团队讨论,诊断为乙状结肠癌IV期(仅肝转移),肝内多发转移灶无法R0切除。因原发灶未出现出血、梗阻等,暂不行原发灶手术,基因检测KRAS突变型,建议行mFOL**6联合贝伐珠单克隆抗体治疗。患者遂于2013年4月至6月行下述方法治疗,具体方案:贝伐珠单克隆抗体5mg/kg(静脉滴注,第1天);奥沙利铂85mg/m2(静脉滴注,第1天);亚叶酸钙400mg/m2 (静脉滴注,第1天);5-氟尿嘧啶400mg/m2(静脉推注,第1天),然后1200mg/(m2•d)×2持续静脉输注,以上方案每2周重复。2013年6月复查后经多学科团队评估,肝内5个病灶均较前缩小(图4~6),达到部分缓解,可以考虑手术切除结肠癌原发灶及肝转移灶,故暂停使用贝伐珠单克隆抗体,行单纯mFOL**6化疗1个周期后行结肠癌原发灶及肝转移灶的一期切除手术。
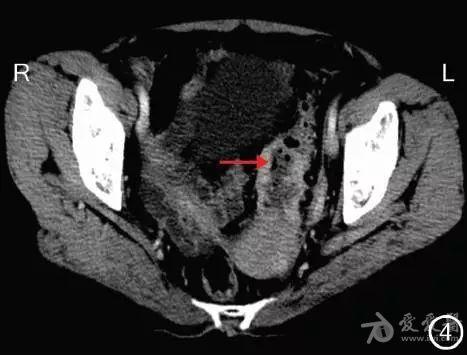
图4 转化治疗后CT检查示乙状结肠病灶(→)
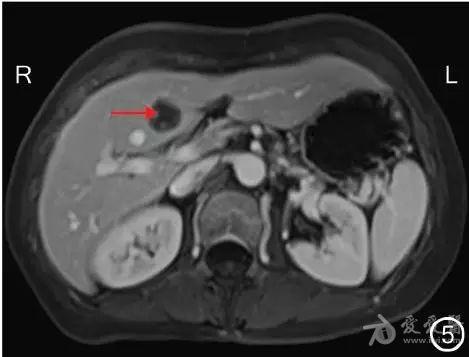
图5 转化治疗后MRI检查示肝左内叶转移灶明显缩小(→)
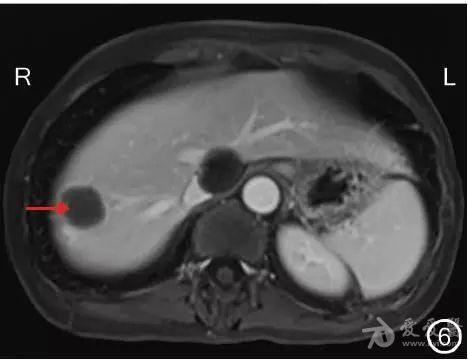
图6 转化治疗后MRI检查示肝右叶近膈顶转移灶明显缩小(→) 1.3 手术方法
2013年7月2日患者在全身麻醉下行结肠癌原发灶联合肝转移灶一期切除术,具体手术方式为开腹肝部分切除+3D腹腔镜辅助乙状结肠癌根治术。 1.3.1 麻醉与**:采用气管插管全身麻醉联合连续硬膜外麻醉。肝部分切除术采取平卧位,乙状结肠癌根治术取头低足高剪刀位。 1.3.2 手术切口及戳孔选择:肝部分切除术取右侧肋缘下切口进腹,长约20cm,置肝拉钩;乙状结肠癌根治术行脐上方1cm穿刺,建立气腹,维持腹内压在15mmHg(1mmHg=0.133kPa)。原脐上方穿刺孔行10mm戳孔,安置镜头。左右脐旁腹直肌外缘行5mm戳孔,安置器械,右髂区行12mm戳孔作为主操作孔。 1.3.3 手术探查:探查腹腔内无腹腔积液,胆囊无特殊改变,肝脏左外叶扪及2个转移灶,直径约0.5cm; 肝左内叶1个,直径约2cm;肝右前叶1个,直径约0.5cm;肝右叶膈顶1个,直径约3cm。乙状结肠中段扪及质地坚硬的包块,直径约6cm,占肠腔一周, 侵犯浆膜;探查腹主动脉前、肠系膜下血管根部及乙状结肠系膜等处未见明显肿大淋巴结,未见盆壁、盆底腹膜种植转移,余胃肠探查无特殊改变。 1.3.4 手术步骤: (1)肝部分切除术:游离肝脏,分别标记肝脏切除范围,术中阻断肝门10min,完整切除肝脏5个转移灶,创面小胆管和小血管分别以1号线结扎,创面仔细缝扎止血(图7)。
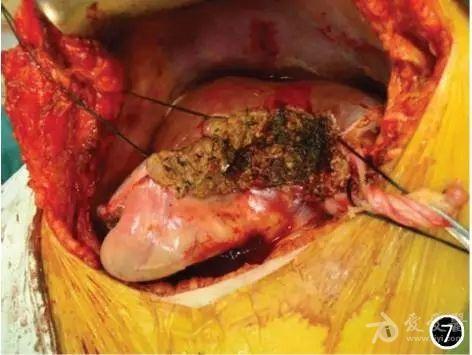
图7 取右肋缘下切口进腹,行肝部分切除术
无菌水冲洗手术野,肝下置入乳胶引流管1根,戳孔引出。清点器械敷料无误后逐层缝合切口。 (2)处理肠系膜下血管及根部淋巴结:分别向上外侧及下外侧牵拉降乙结肠和直乙结肠交界处的系膜,辨认腹主动脉分叉处,从骶角水平开始沿腹主动脉向上剥离肠系膜,裸化肠系膜下血管并清扫血管周围淋巴结,期间需注意避免损伤脏层筋膜背侧上腹下神经。术者于肠系膜下动脉与左结肠动脉分叉远端, 直肠上动脉及乙状结肠动脉分别置Hemo-Lock夹闭, 离断血管,清扫血管周围淋巴组织(图8,9)。
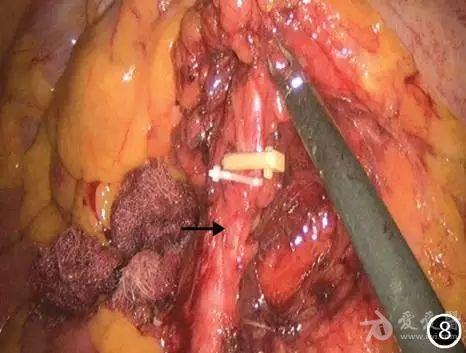
图8 游离并裸化肠系膜下动脉(→),清扫血管周围淋巴结并离断直肠上动脉
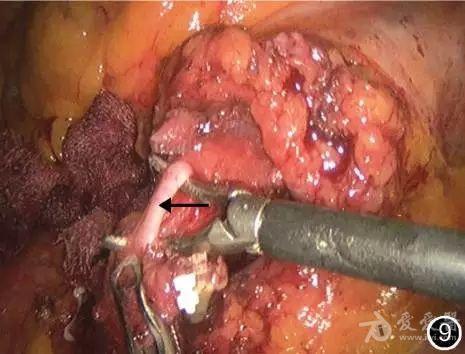
图9 游离乙状结肠动脉(←)并离断
(3)游离肠段:将乙状结肠向左侧牵拉,由Toldt′s筋膜和Gerota筋膜之间向外侧分离(图10), 显露下方的左输尿管并予以保护(图11)。
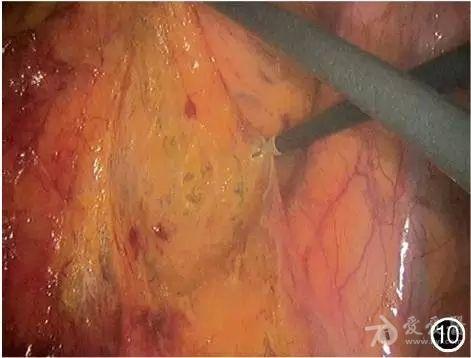
图10 向左牵拉肠管,由乙状结肠右侧开始向外侧分离
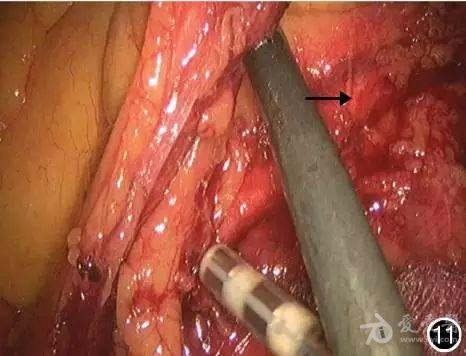
图11 分离组织显露左侧输尿管(→)
将乙状结肠牵向中线,从Toldt′s线进入左侧Toldt′s间隙并逐渐向内侧分离,将乙状结肠系膜同腹膜后结构分开(图12),期间需注意避免损伤骶前神经。内外侧分离后将乙状结肠完全游离(图13),同时向下游离部分直肠上段(图14)。
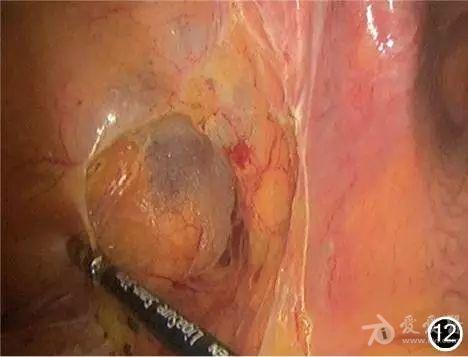
图12 由肠管另一边向内侧分离,同时将乙状结肠系膜同腹膜后结构分开
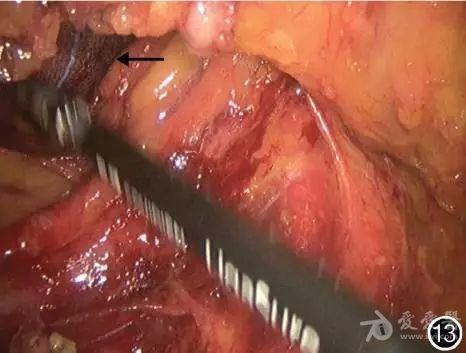
图13 两侧分离至“会师”,于乙状结肠下方可见对侧纱布(←),乙状结肠完全游离
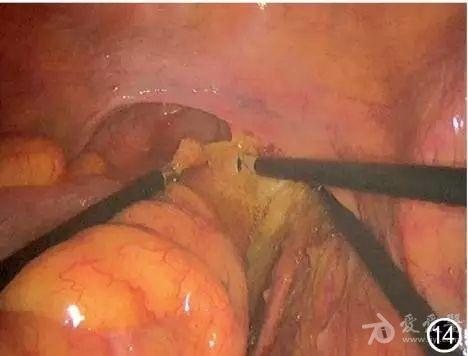
图14 向下游离部分直肠上段
(4)切除肠段:中止气腹,在腹部正中耻骨联合上方行长度为5cm切口,置塑料套保护后拖出游离的乙状结肠,在肿瘤近端10cm处电刀切除系膜裸化肠管,予荷包钳夹闭穿针并切断肠管,断面消毒后置入抵钉座,收紧荷包线并打结(图15)。
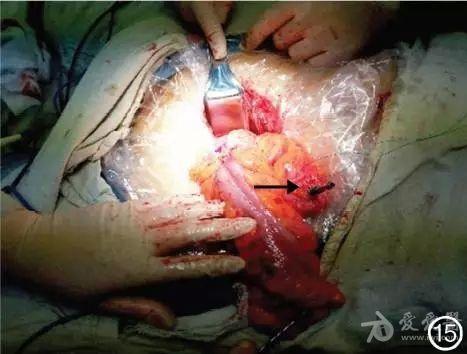
图15 腹部切口拖出游离肠管,离断并放置抵钉座待吻合(→)
肿瘤远端5cm 处分离钳辅助离断,将全部乙状结肠和直肠上段、相应结肠系膜和直肠系膜及直肠系膜下动脉根部淋巴结等一并作整块切除,移去标本,远断端缝线加固。 (5)吻合肠断端:扩肛至6指,消毒会**,无菌水冲洗肛管及直肠至清洁,将吻合器体部自**伸入并与抵钉座嵌合,经腹部切口直视下完成降结肠-直肠端端吻合,检查上下切缘完整,间断加固吻合口1圈,检查吻合口无张力,血供好,无出血及瘘, 肠管无扭转,手术区域无活动性出血。大量无菌水冲洗盆腔后间断缝合系膜裂孔,并于垂直吻合口后方置引流管1根,由穿刺孔引出。清点器械敷料无误后逐层缝合切口。
1.4 术后辅助治疗 患者术后安全返回病房,予常规应用抗生素及营养支持,术后行mFOL**6化疗,2013年9-11月, 行mFOL**6联合贝伐珠单克隆抗体治疗6个周期,行围术期化疗半年(具体方案同前)。2013年11月至2014年4月,口服卡培他滨半年,具体方案: 卡培他滨1250mg/m2每日2次口服,第1~14天, 每3周重复。其后停止辅助治疗。
1.5 观察指标 转化治疗后行肿瘤标志物检测、腹盆腔CT及腹上区MRI等检查,观察肝内转移灶大小变化,肿瘤标志物变化情况。术中观察手术时间、术中出血量、淋巴结清扫数目、生命体征等。术后观察患者肝功能、下床活动时间、**排气时间、引流管拔出时间、住院时间及术后并发症、病理学检查结果、肿瘤复发及转移情况。
1.6 随访 患者出院后每月行肿瘤标志物检测及B超、胸部X线片检查至2014年1月,每半年行腹盆腔CT、腹上区MRI及肠镜等检查,并通过门诊或电话方式进行随访,了解肿瘤复发转移情况,随访时间截至2015年9月。
2 结果 患者进行4个周期化疗,经转化治疗1个月余,肝内2个较大转移灶直径缩小至3.2cm和2.0cm, 肿瘤标志物CEA下降为95.9μg/L,CA19-9下降为252.4kU/L,达到手术要求。患者顺利完成结肠癌原发灶联合肝转移灶一期切除术,手术时间为280min, 术中出血量为250mL,未输血,清扫淋巴结14枚, 均未见转移,另见癌结节1枚,术中生命体征平稳。患者术后恢复顺利,术后第1天ALT和AST分别为1147U/L和2631U/L,术后第7天分别为101U/L 和37U/L。术后第2天下床活动,第3天**排气, 第7天拔除引流管,第9天出院。患者术后未见明显吻合口瘘、出血及感染等并发症。术后病理学诊断:乙状结肠溃疡型腺癌T3N1cM1期(合并肝转移性腺癌)。患者术后第40天行方案为mFOL**6 和口服卡培他滨的辅助治疗。患者随访30个月,生命质量良好,无复发转移出现。 3 讨论 由于缺乏前瞻性随机对照研究的证据,同时性结直肠癌肝转移行原发灶及肝转移灶一期切除的近远期疗效仍存争议。尤其是经全身化疗转化治疗后肝脏会存在不同程度的损伤,行一期同步切除对患者术后恢复的影响及远期疗效尚未可知。一期同步切除的优势主要在于减少第2次手术打击、降低治疗费用,缩短治疗周期,减少治疗过程中肿瘤进展和转移的发生率[11-12]。然而一期切除可能增加手术风险(如腹腔感染、吻合口瘘、肝功能不全等),尤其在经过数个周期转化治疗后肝功能受到一定影响,再行一期同步手术风险更高。部分研究结果发现:原发灶及肝转移灶一期同步手术的并发症发生率及手术死亡率高于二期分阶段手术,因此,建议原发灶或转移灶切除2~3个月后再行二期手术[13-14]。随着近年来外科技术、外科器械及围术期管理方式及理念的进步,越来越多的研究结果显示:一期手术并发症发生率和手术死亡率并不显著高于二期手术[15-18]。 本例结肠癌患者初始转移灶无法R0切除、转化治疗后行原发灶及肝转移灶一期切除术,一定程度上反映出转化治疗后行一期切除手术,在合理的围术期处理下具有良好的安全性。另外,笔者团队目前正在进行的一项回顾性病例研究结果发现:转化治疗后患者一期切除的手术时间及术后住院时间显著短于二期分阶段手术,且术中出血量、术后恢复情况、术后并发症发生情况与二期分阶段手术比较,差异无统计学意义。 因此,结合笔者的临床经验及其他近期研究结果发现:结直肠癌肝转移患者转化治疗后,行结直肠癌原发灶及肝转移灶一期同步切除手术安全可行, 近期疗效满意。但对于因化疗或者其他疾病导致肝功能较差、全身情况评估无法耐受一期同步手术的患者,仍需行分期切除。另外,同期手术还应取决于手术医师的经验与技术[19]。有文献报道转化治疗须在2~4个月内完成,>6个月的转化治疗疗效常不理想,且过多周期化疗易致肝功能受损明显,从而影响手术[20]。 综上,转化治疗后的结肠癌原发灶及肝转移灶行一期切除手术可降低2次手术打击,缩短总住院时间,减少住院费用,其术后安全性及短期疗效较好。该手术方式的远期疗效尚待后续研究结果证实。
参考文献
[1] Steward BW, Kleihues P. World Cancer Report[M].Lyon: IARCPress,2003:198-202. [2] Parkin DM,Bray F, Ferlay J, et al. Global cancer statistics, 2002[J]. CACancerJ Clin,2005,55(2):74-108.DOI:10. 3322/canjclin.55.2.74. [3] Kemeny N. Management of liver metastases from colorectal cancer [J]. Oncology (Williston Park), 2006,20(10):1161-1176, 1179;discussion1179-1180,1185-1186. [4] Clark ME, Smith RR. Liver-directed therapies in metastati ccolorectal cancer[J]. J Gastrointest Oncol,2014,5(5):374-387. DOI:10.3978/j.issn.2078-6891.2014.064. [5] Khan K, Wale A, Brown G, et al. Colorectal cancer with liver metastases: neoadjuvant chemotherapy, surgical resection firstor palliationalone?[J].WorldJGastroenterol,2014,20(35): 12391-12406.DOI:10.3748/wjg.v20.i35.12391. [6] Abdalla EK, Vauthey JN, Ellis LM, et al. Recurrence and outcomes following hepatic resection, radiofrequency ablation, and combined resection /ablation for colorectal liver metastases[J]. Ann Surg,2004,239(6):818-827.DOI:10.1097/01.sla. 0000128305.90650.71. [7] Pawlik TM, Choti MA. Surgical therapy for colorectal metastases totheliver [J]. J Gastrointest Surg,2007,11(8):1057-1077. DOI:10.1007/s11605-006-0061-3. [8] Ye LC, Liu TS, Ren L, et al. Randomized controlled trial of cetuximab plus chemotherapy for patients with KRASwild-type unresectable colorectal liver-limited metastases [J].J Clin Oncol, 2013,31(16):1931-1938.DOI:10.1200/JCO.2012.44.8308. [9] 顾晋.结直肠癌规范化外科治疗的问题与对策[J].中华消化外科杂志,2015,14(6):441-444.DOI:10.3760/cma.j.issn. 1673-9752.2015.06.001. [10]Chua HK, Sondenaa K, Tsiotos GG,et al. Concurrentvs. staged colectomy and hepatectomy for primary colorectal cancer with synchronous hepaticme tastases [J].Dis Colon Rectum,2004,47 (8):1310-1316.DOI:10.1007/s10350-004-0586-z. [11] 韦烨,林奇,汤文涛,等.同期切除结直肠癌肝转移的长期疗效及其影响因素分析[J].中华胃肠外科杂志,2015,18(9):925- 929.DOI:10.3760/cma.j.issn.1671-0274.2015.09.018 [12]Lyass S, Zamir G, MatotI,et al. Combined colon and hepatic resection for synchronous colorectal liver metastases[J].J Surg Oncol,2001,78(1):17-21.DOI:10.1002/jso.1117. [13] Bolton JS, Fuhrman GM. Survival after resection of multiple bilobar hepatic metastases from colorectal carcinoma[J]. Ann Surg, 2000,231(5):743-751. [14] Jaeck D, Bachellier P, Weber J C,et al. Surgical treatment of synchronous hepatic metastases of colorectal cancers. Simultaneous or delayed resection?[J].AnnChir,1996,50(7):507-516. [15] 史颖弘,周俭,樊嘉.结直肠癌肝转移的外科治疗[J].中华消化外科杂志,2014,13(3):168-170.DOI:10.3760/cma.j.issn. 1673-9752.2014.03.003. [16] Martin R, Paty P, Fong Y, et al. Simultaneous liver and colorectal resections are safe for synchronous colorectal liver metastasis [J].J Am Coll Surg,2003,197(2):233-242.DOI:10.1016/ S1072-7515(03)00390-9. [17] Tanaka K, Shimada H, Matsuo K, et al. Outcome after simultaneous colorectal and hepatic resection for colorectal cancer with synchronous metastases [J]. Surgery, 2004, 136(3):650-659. DOI: 10.1016/ j. surg.2004.02.012. [18]Luo Y, Wang L, Chen C, et al. Simultaneous liver and colorectal resections are safe for synchronous colorectal liver metastases[J]. J Gastrointest Surg, 2010,14(12):1974-1980. DOI:10.1007/ s11605-010-1284-x. [19] 马宽生,张哲菠.不同阶段结直肠癌肝转移的手术策略[J].中华消化外科杂志,2014,13(3):165-167.DOI:10.3760/cma.j. issn.1673-9752.2014.03.002. [20] 中华医学会外科学分会胃肠外科学组,中华医学会外科学分会结直肠**外科学组,中国抗癌协会大肠癌专业委员会.结直肠癌肝转移诊断和综合治疗指南(V2013)[J].中华胃肠外科杂志,2013,16(8):780-788.DOI:10.3760/cma.j.issn. 1671-0274.2013.08.020
|
